Indice
Introduzione
Il test oculare Alzheimer che dura appena cinque secondi sembra uscito da un film di fantascienza: guardi una luce rossa tenue, una fotocamera registra come si muovono le proteine nella retina e, zac, il sistema identifica pattern associati alla malattia. Sembra magia? È fisica applicata alla medicina—e potrebbe cambiare il modo in cui parliamo di diagnosi precoce Alzheimer.
La tecnica ha un nome tosto, spettroscopia a diffusione dinamica (DLS), ma l’idea di fondo è semplice: la retina è “un pezzo di cervello” esposto alla luce, quindi ciò che succede lì spesso rispecchia ciò che accade nell’encefalo. In queste righe vedremo come funziona, cosa dicono gli studi pubblicati, perché non è ancora un esame “da ambulatorio” e quali scenari apre per screening accessibili e non invasivi. Pronto a far lavorare gli occhi?
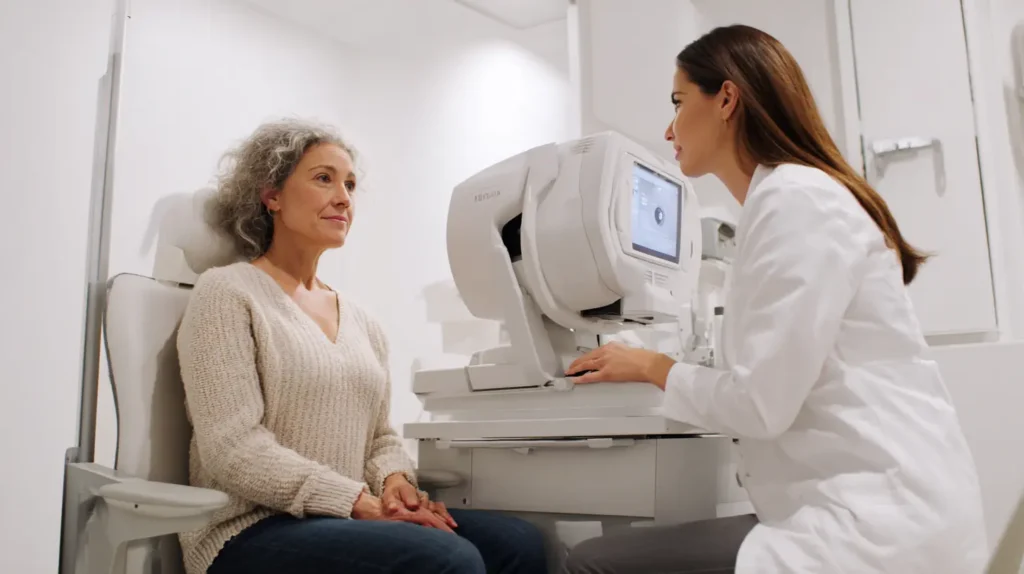
Occhi sul cervello: perché la retina parla di Alzheimer
Tra retina e cervello non c’è solo un collegamento anatomico: c’è una parentela diretta. La retina è tessuto neurale, con cellule e sinapsi che condividono origini embrionali con il sistema nervoso centrale. E se l’Alzheimer è un’alterazione neurodegenerativa che coinvolge proteine come amiloide-β e tau, ha senso cercarne le tracce dove i neuroni sono a portata di… sguardo.
Negli ultimi anni, la comunità scientifica ha accumulato prove che biomarcatori oculari—dal microcircolo retinico alle proprietà ottiche dei tessuti—correlano con i diversi stadi di malattia. Il passo ulteriore è capire se la retina possa offrire un indice sensibile e ripetibile prima dei sintomi clinici, così da intercettare chi è a rischio e indirizzarlo ai test diagnostici standard (PET amiloide, biomarcatori nel liquido cerebrospinale, test neuropsicologici).
Cos’è la spettroscopia a diffusione dinamica (DLS) spiegata semplice
Immagina di puntare una luce su una folla in movimento e usare una videocamera super sensibile per misurare i microspostamenti delle persone. La DLS fa qualcosa di simile con le proteine: illumina la retina con una luce controllata e registra le fluttuazioni di scattering (la “diffusione” della luce) causate dal loro movimento browniano. Analizzando come cambia nel tempo l’intensità della luce diffusa, si stima la dinamica delle molecole: più lente o più veloci, più aggregate o più libere.
Nel contesto dell’Alzheimer, la logica è: se nella retina aumentano aggregati proteici o cambiano le proprietà del fluido extracellulare, la firma dinamica della luce diffusa cambia. Con un protocollo brevissimo—circa 5 secondi davanti a una luce rossa tenue—si registra una curva temporale. Algoritmi e modelli fisici stimano indici di diffusione: sono questi a distinguere controlli, soggetti con compromissione cognitiva lieve e persone con accumulo cerebrale di amiloide documentato alla PET.

Cosa dicono gli studi: segnali forti, prudenza d’obbligo
Il cuore della notizia è un lavoro peer‑reviewed pubblicato nel 2025 su Journal of Alzheimer’s Disease, in cui ricercatori statunitensi descrivono un sistema DLS non invasivo in grado di discriminare, in pochi secondi, i profili di soggetti con evidenza di amiloide rispetto ai controlli. In parallelo, una rassegna sullo stesso giornale discute il razionale fisico‑biologico e il potenziale della tecnica per anticipare la diagnosi. Altre linee di ricerca indicano che biomarcatori retinici—anche con metodiche diverse (OCTA, FLIO, imaging multimodale)—tracciano alterazioni vascolari e metaboliche coerenti con le fasi della malattia.
È importante essere chiari: parlare di test oculare Alzheimer non significa avere già in mano un esame sostitutivo della PET o del prelievo di liquor. La letteratura attuale dice “promettente”: i dataset sono ancora piccoli, servono validazioni multicentriche, standardizzazione degli strumenti, cut‑off riproducibili e follow‑up longitudinali. In altre parole, il quadro è autorevole e realistico, ma siamo nella fase di trasferimento clinico.

Nota per il lettore: la scienza corre, ma la medicina clinica ha bisogno di certezze statistiche e protocolli regolatori. È corretto parlare di “svolta potenziale”, non di diagnosi già disponibile per tutti.
Perché un test oculare in 5 secondi può cambiare lo screening
Tre parole: veloce, non invasivo, accessibile. La combinazione è rara nella diagnostica dell’Alzheimer. Una PET amiloide richiede radiofarmaci e strutture specializzate; il liquido cerebrospinale implica puntura lombare; i test neuropsicologici sono fondamentali ma risentono di variabili culturali ed emotive. Un test oculare Alzheimer brevissimo con costo potenzialmente contenuto potrebbe aprire scenari di screening su larga scala: tutti fanno l’esame rapido; chi risulta “a rischio” prosegue con i percorsi standard. Questo triage intelligente ridurrebbe liste d’attesa e costi, anticipando l’accesso a cure e trial.
In termini di salute pubblica, la diagnosi precoce Alzheimer è cruciale: oggi esistono farmaci che rallentano la progressione in fasi iniziali e, soprattutto, interventi su stile di vita (attività fisica, dieta, controllo di pressione/diabete, qualità del sonno) che migliorano l’outcome. Scoprire prima significa guadagnare tempo—il bene più prezioso quando si parla di memoria.
Dentro la macchina: come si svolge l’esame (e cosa misura davvero)
Un protocollo tipico di DLS retinica segue questi passi: (1) la persona si siede davanti a un dispositivo che sembra un retinografo; (2) fissa per ~5 secondi una luce rossa attenuata; (3) un sensore registra le fluttuazioni temporali della luce diffusa; (4) il software calcola curve di autocorrelazione e stima coefficienti di diffusione. Nel referto, invece di un’immagine classica, si ottiene un indice numerico—una “firma dinamica” che può essere confrontata con soglie di riferimento definite in studi clinici.
Cosa misura davvero? Non “vede” direttamente l’amiloide, ma inferisce cambiamenti nel microambiente proteico (dimensione/aggregazione, viscosità del mezzo, interazioni molecolari) che correlano con i processi patologici. È un approccio fisico complementare a tecniche ottiche già note; la promessa è una sensibilità elevata ai cambiamenti iniziali.
Limiti e domande aperte: dal laboratorio all’ambulatorio
Per passare dal “potenziale” alla routine clinica, la DLS deve superare alcuni gradini:
- Standardizzazione: strumenti, lunghezze d’onda, geometrie ottiche e parametri di acquisizione devono essere armonizzati tra centri.
- Riproducibilità: i risultati devono essere stabili tra visitatori multipli e nel tempo, con errori sistematici contenuti.
- Cut‑off clinici: definire soglie interpretative che massimizzino sensibilità e specificità in popolazioni diverse (per età, comorbidità, etnia).
- Confronto con gold standard: correlazione con PET, CSF e outcome cognitivi longitudinali.
- Etica e comunicazione: uno screening positivo non equivale a diagnosi. Servono percorsi chiari di consenso informato e counseling.
Queste non sono “frenate”: sono il percorso normale con cui qualsiasi nuova tecnologia diventa medicina.
Confronto con altre tecniche retiniche: dove si colloca la DLS
La retina è un laboratorio di idee diagnostiche per l’Alzheimer. Ecco come la DLS si posiziona rispetto ad altre metodiche:
- OCTA (angiografia OCT): fotografa il microcircolo. Diversi studi mostrano riduzione della densità vascolare e alterazioni della FAZ (foveal avascular zone) in fase prodromica. Molto utile, ma misura vasi, non dinamica proteica.
- FLIO (fluorescence lifetime imaging ophthalmoscopy): analizza i tempi di vita della fluorescenza retinica, sensibili a metabolismo e composizione tissutale.
- Imaging multimodale: combina più segnali ottici per aumentare robustezza e specificità.
La DLS è complementare: non guarda ai vasi o alla fluorescenza, ma alla fisica del movimento molecolare. In un futuro plausibile, un pannello retinico potrebbe integrare più letture (OCTA + FLIO + DLS) per uno screening ancora più solido.

Dati clinici finora: cosa sappiamo sui numeri
Gli studi pubblicati riportano coorti ridotte—decine di partecipanti—ma con risultati coerenti: in soggetti con compromissione cognitiva lieve e PET amiloide positiva, gli indici DLS mostrano pattern significativamente differenti rispetto a controlli o PET negativa. La durata di acquisizione è breve (quasi sempre entro 5–10 secondi), la tollerabilità alta e la ripetibilità promettente. Alcuni team stanno avviando trial clinici per consolidare i cut‑off e quantificare la capacità predittiva nel tempo.
Link autorevole: dettagli metodologici e risultati sono descritti nello studio su Journal of Alzheimer’s Disease disponibile su PubMed — clicca per leggere abstract e riferimenti.
Chi potrebbe beneficiarne per primo
- Centri memoria con liste d’attesa per PET o puntura lombare: la DLS come pre‑triage a basso costo.
- Programmi di prevenzione in soggetti a rischio familiare o con fattori vascolari: uno screening rapido per indirizzare a valutazioni più profonde.
- Trial farmacologici in fase iniziale: arruolamento più veloce grazie a un filtro oculare non invasivo.
Non parliamo di “autotest” domestici: parliamo di strumenti clinici gestiti da personale addestrato, con protocolli e consenso informato.
Sicurezza, comfort e accessibilità
Un vantaggio pratico del test oculare Alzheimer con DLS è la sicurezza: luce a bassa intensità, nessun mezzo di contrasto, zero radiazioni. L’esame richiede collaborazione minima: fissare un punto per pochi secondi. Per chi ha difficoltà a stare fermo, si possono ripetere più acquisizioni e mediarle. La portabilità degli strumenti, se confermata dai produttori, potrebbe portare la tecnologia fuori dai grandi ospedali—ambulatori territoriali, cliniche oculistiche, persino unità mobili in progetti di prevenzione.

Impatto sociale: dal timore alla consapevolezza
L’Alzheimer spaventa, perché tocca identità e autonomia. Offrire un percorso di valutazione che non faccia male e non spaventi è già una forma di cura. Un test rapido può tradursi in dialoghi più precoci tra persone, famiglie e medici; può stimolare l’adesione a stili di vita sani; può aiutare a pianificare. La tecnologia, da sola, non basta. Ma può creare tempo—e il tempo permette scelte migliori.
Domande frequenti (FAQ) in chiave pratica
Il test oculare Alzheimer con DLS sostituisce la PET? No. Al momento è uno strumento complementare e di screening: identifica chi merita esami di conferma.
Quanto è accurato? I dati preliminari sono incoraggianti, ma la precisione diagnostica definitiva richiede studi più ampi e standardizzati.
È disponibile in Italia? La disponibilità dipende dai centri di ricerca e dalle autorizzazioni. Informati presso centri memoria universitari e IRCCS.
È adatto a tutti? Come ogni esame oftalmologico, ci sono controindicazioni relative (ad esempio opacità corneali/lenticolari importanti) che valutano il medico oculista e il team.
Quanto costa? Non ci sono ancora tariffe standard. I costi dipenderanno dal dispositivo, dal contesto (ricerca vs clinica), dai volumi e dalla manutenzione.
Cosa aspettarsi nei prossimi 3–5 anni
- Trial multicentrici per validare sensibilità/specificità su migliaia di soggetti.
- Dispositivi più compatti e workflow integrati con cartelle cliniche digitali.
- Algoritmi di analisi più robusti (machine learning) per interpretare i segnali DLS.
- Pannelli retinici integrati (DLS + OCTA + FLIO) per aumentare il valore predittivo.
- Linee guida di società scientifiche su quando e come usare il test nello screening.
Se tutte queste tessere andranno al loro posto, parlare di diagnosi precoce Alzheimer a partire dalla retina non sarà più “potenziale”, ma routine.

Come parlare correttamente di prevenzione (senza promettere miracoli)
La prevenzione dell’Alzheimer non esiste in senso stretto, ma molte abitudini—attività fisica regolare, dieta mediterranea, sonno di qualità, controllo dei fattori di rischio cardiovascolare, stimolazione cognitiva—sono associate a un minor rischio e a un decorso più lento. Il merito di un test oculare Alzheimer rapido non è annunciare cure miracolose, ma mettere prima le persone giuste sul binario dei controlli e degli interventi efficaci.
Conclusione
Un esame che in 5 secondi legge nei nostri occhi indizi di ciò che accade nel cervello: la spettroscopia a diffusione dinamica applicata alla retina è una delle piste più interessanti della medicina di frontiera. Le prove scientifiche ci sono, i limiti sono chiari, la strada regolatoria è davanti. Ma la direzione è quella giusta: diagnosi precoce Alzheimer, non invasiva e accessibile. E se per iniziare bastasse… uno sguardo? Battuta finale: niente “occhi da cerbiatto”, qui servono “occhi da scienziato”—ma promettono bene per tutti.
Riferimenti essenziali per approfondire
- J.N. Weiss et al., Dynamic light scattering of the eye in the diagnosis of Alzheimer’s disease, Journal of Alzheimer’s Disease (2025), abstract su PubMed.
- J.N. Weiss, Dynamic Light Scattering Spectroscopy as an Early, Noninvasive, Quantitative Test to Diagnose Alzheimer’s Disease, Journal of Alzheimer’s Disease (2025), testo integrale su PMC.
- NIH/NIA, Changes in the retina linked to stages of Alzheimer’s disease (2023), pagina ufficiale.
“Leggi anche: Lenti a contatto infrarosse occhi chiusi – essenziale guida”